kimia
Secara makroskopis campuran antara susu instan dengan air tampak homogen. Susu larut tetapi larutan tidak bening, melainkan keruh. Jika didiamkan campuran ini tidak memisahdan juga tidak dapat dipisahkan dengan penyaringan (hasil penyaringan tetap keruh). Secara makroskopis campuran ini tampak homogen.Akan tetapi ,jika diamati dengan mikroskop ultra ternyata masih dapat dibedakan partikel-partikel lemak susu yang tersebar di dalam air. Campuran ini disebut koloid. Ukuran partikel koloid berkisar antara 1 nm – 100 nm. Jadi, koloid tergolong campuran heterogen dan merupakan sistem dua fase. Zat yang didispersikan disebut fase terdispersi, sedangkan medium yang digunakan untuk mendispersikan zat disebut medium dispersi.
HAL | LARUTAN | KOLOID | SUSPENS | |
| Kesetabilan | stabil | stabil | tidak stabil | |
| Fase | 1 Fase | 2 Fase | 2 Fase | |
| Ukuran terdispersi | <10-7 cm | 10-7- 10-5 cm |
| |
Dapat di saring | tidak dapat disaring | tidak dapat disaring | dapat di saring | |
| Homogen/heterogen | Homogen | Heterogen | Heterogen |
2. Jenis koloid, lengkapi daftar berikut:
| No | Fase terdispersi | Fase pendispersi | Nama koloid | contoh |
| 1 | Padat | Gae | aerosol padat | asap dan udara |
| 2 | padat | cair | sol | tinta ,cat,darah |
| 3 | padat | cair | sol padat | kaca berwarna |
| 4 | cair | gas | aerosol cair | awan dan kabut |
| 5 | cair | cair | emulasi | susu dan santan |
| 6 | cair | padat | gel | jelly, agar- agar |
| 7 | gas | cair | buih | buih sabun |
| 8 | gas | padat | buih padat | batu apung |
3. Nyatakanlah jenis koloid berikut (tergolong sol,emulsi, atau yang lainnya).
a. Kabut (AEROSOL CAIR)
b. Lem kanji (SOL)
c. Cat (SOL)
d. Tinta (SOL)
e. Mutiara (GEL)
f. Batu apung (BUIH PADAT)
g. Air susu (EMULSI)
h. Air sungai (SOL)
i. Minyak ikan (EMULSI)
j. Air sabun (SOL)
SIFAT-SIFAT KOLOID
Sistem koloid memiliki sifat yang khas yang berbeda dari sifat larutan maupun suspensi.
A. EFEK TYNDALL
a. Apakah yang dimaksud dengan efek Tyndall ?
Jawab: Efek Tyndall adalah efek penghamburan cahaya oleh partikel koloid.
b. Bagaimanakah sifat koloid terhadap cahaya?
Jawab: Cahaya dihamburkan, partikel berdispersi tidak terlihat
c. Bagaimanakah membedakan larutan sejati dari sistem koloid?
Jawab: Menyinari larutan dengan cahaya. Karena larutan meneruskan cahaya sedangkan koloid menghamburkan cahaya
d. Sebutkan beberapa contoh efek Tyndall dalam kehidupan sehari-hari!
Jawab:
· Sorot lampu mobil ketika berkabut.
· Sorot lampu proyektor film dalam bioskop yang diberi asap. ko berkabut.
B. KOAGULASI KOLOID
a. Apakah yang dimaksud dengan koagulasi!
Jawab: Koagulasi adalah penggumpalan koloid akibat hilangnya muatan koloid.
b. Apa yang menyebabkan peristiwa koagulasi?
Jawab:
· Percampuran koloid beda muatan
· Penambahan elektrolit
· Elektroforesis
c. Bagaimana proses terjadinya koagulasi?
Jawab:
Koagulasi kimiawi dapat terjadi karena:
· Percampuran koloid beda muatan
Menyebabkan koloid saling menetralkan satu sama lain dan menggumpal.
· Penambahan elektrolit
Elektrolit dapat menetralkan koloid dan menyebabkan koagulasi. Koagulasi terjadi bila koloid positif ditambah elektrolit yang lebih negatif, dan koloid negatif ditambah elektrolit yang lebih positif.
· Elektroforesis
Terjadi ketika koloid mencapai elektroda.
Koagulasi mekanik dapat terjadi dengan cara menaik-turunkan suhu dan pengadukan sistem koloid.
d. Apakah muatan sol Fe(OH)3 dengan sol As2S3?
jawab:
· Koloid Fe(OH)3 bermuatan positif, mudah terkoagulasi jika ditambahkan H2SO4 atau Na3PO4 dibanding HCl atau NaBr.
· Koloid As2S3 bermuatan negatif, mudah terkoagulasi jika ditambahkan BaCl2 dibanding NaCl.
e. Sebutkan beberapa contoh koagulasi dalam kehidupan sehari-hari!
Jawab:
· Mekanik : protein agar-agar dalam air akan menggumpal bila didinginkan
· Fisis : penggunakaan alat cottrel
· Kimia : proses pengolahan karet dari bahan mentah (lateks) dengan menambahkan asam formiat ) cuka
C. ELEKTROFORESIS
- Apakah yang dimaksud dengan elektroforesis?
Jawab: Elektroforesis adalah sifat partikel koloid yang dapat bergerak dalam medan listrik.
- Apa yang menyebabkan peristiwa elektroforesis?
Jawab: Adanya pengaruh medan listrik
- Bagaimana proses terjadinya elektroforesis?
Jawab: Dengan memberi medan listrik di sekitar koloid.
· Koloid positif akan bergerak ke katoda atau elektroda negatif.
· Koloid negatif akan bergerak ke anoda atau elektroda positif.
- Sebutkan beberapa contoh elektroforesis dalam kehidupan sehari-hari!
Jawab:
· Penyaring debu pada pabrik
· Mengidentifikasi DNA manusia
· Proses pembuatan sarung tangan karet
D. DIALISIS
- Apakah yang dimaksud dengan dialisis?
Jawab: Dialisis adalah cara mengurangi ion-ion pengganggu yang terdapat dalam sistem koloid dengan menguunakan selaput semipermeabel
- Apa yang menyebabkan peristiwa dialisis?
Jawab: Adanya ion-ion pengganggu
- Bagaimana proses terjadinya dialisis?
Jawab: Dengan cara memasukan dispersi koloid ke dalam kantong semipermeabel da mencelupkannya kedalam air mengalir
- Sebutkan beberapa contohdialisis dalam kehidupan sehari-hari!
Jawab: Hermodialisis pada penderita gagal ginjal
E. GERAK BROWN
- Apakah yang dimaksud dengan gerak brown?
Jawab: Gerak brown adalah gerak acak zig-zag partikel koloid
b. Apa yang menyebabkan peristiwa gerak brown?
Jawab: Karena adanya tumbukan tak setimbang antara partikel terdispersi dengan pendispersi.
- Bagaimana proses terjadinya gerak brown?
Jawab: Proses terjadinya gerak brown di pengaruhi oleh suhu. Jika suhu dalam sistem koloid cenderung tinggi maka energi kinestetik yang ada dalam medium pendispersinya akan semakin besar
- Sebutkan beberapa contohgerak brown dalam kehidupan sehari-hari!
Jawab:
· Gerak debu yang terlihat pada seberkas sinar
· Gerakan partikel susu ketika terkena berkas cahaya
F. ADSORPSI
- Apakah yang dimaksud dengan adsorpsi?
Jawab: Adsorpsi adalah sifat partikel koloid yang dapat menyerap ion atau molekul netral pada permukaannya.
- Apa yang menyebabkan peristiwa adsorpsi?
Jawab: Adanya kemampuan partikel koloid untuk manarik partikel-partikel kecil
- Bagaimana proses terjadinya adsorpsi?
Jawab: Partikel koloid mampu menyerap molekul netral atau ion-ion pada permukaannya. Ketika partikel koloid menyerap ion bermuatan, ion-ion tersebut akan menempel pada permukaannya dan partikel koloid tersebut menjadi bermuatan
- Sebutkan beberapa contoh adsorpsi dalam kehidupan sehari-hari!
Jawab:
· Penjernihan air
· Pembuatan obat norit
· Pemutihan gula tebu.
Temukan nama-nama sistem koloid dalamwords squareberikut!
Jawab:
1. Aerosol padat
2. Sol
3. Sol padat
4. Aerosol cair
5. Emulsi
6. Emulsi padat
7. Buih
8. Buih padat
| No | Nama koloid | Fase terdispersi | Fase pendispersi | contoh |
| 1 | aerosol padat | padat | gas | udara dan asap |
| 2 | sol | padat | cair | tinta dan darah |
| 3 | sol padat | padat | padat | kaca berwarna |
| 4 | aerosol cair | cair | gas | awan dan farfum |
| 5 | emulasi | cair | cair | susu dan santan |
| 6 | gel | cair | padat | jelly dan agar-agar |
| 7 | buih | gas | cairai | buih sabun |
| 8 | buih padat | gas | padat | batu apung |
LARUTAN PENYANGGA
Jawablah pertanyaan-pertanyaan berikut ini:
1. Apakah yang dimaksud larutan buffer?
2. Campuran yang bagaimana yang dapat menghasilkan larutan buffer?
3. Dari campuran berikut ini, mana yang menghasilkan larutan buffer?
- Campuran 100 mL HCN 0,1 M + 10 mL NaCN 0,1 M
- Campuran 100 mL CH3COOH 0,1 M + 100 mL KOH 0,1 M
- Campuran 20 mL CH3COOH 0,1 M + 10 mL NaOH 0,5 M
- Campuran 10 mL HCl 0,5 M + 20 mL NaCl 0,1 M
- Campuran 100 mL CH3COOH 0,1 M + 100 mL NH4Cl 0,1 M
- Campuran 10 mL NH4OH 0,1 M + 30 mL (NH4)2SO4 0,1 M
- Campuran 10 mL NH4OH 0,5 M + 20 mL HNO3 0,1 M
- Campuran 100 mL NH4OH 0,1 M + 50 mL H2SO4 0,1 M
- Campuran 100 mL NH4OH 0,1 M + 50 mL H2SO4 0,1 M
- Campuran 100 mL NH4OH 0,1 M + 50 mL HCl 0,05 M
4. Sebanyak 50 mL larutan asam asetat 0,1 M dicampur dengan 20 mL larutan kalsium hidroksida 0,1 M. Tentukan pH larutan-larutan itu sebelum dan sesudah dicampurkan. Ka asam asetat = 1 x 10-5.
5. Hitunglah perbandingan volum larutan NH4Cl dan NH3 0,1 M yang harus dicampurkan untuk membuat larutan buffer dengan pH = 8.
Kb NH3 = 1 x -5.
6. Berapa gram Ca(CH3COO)2 harus ditambahkan ke dalam 100 mL larutan CH3COOH 0,1 M sehingga pH nya menjadi dua kali semula?
(Ka CH3COOH = 1 x 10-5; H = 1; C = 12; O = 16; Ca = 40)
7. Sebanyak 690 mg HCOOH dan 566 mg NaHCOO dilarutkan dalam air sehingga 100 mL larutan. Ka HCOOH = 2 x 10-4.
a. tentukanlah pH larutan tersebut.
b. Jika ke dalam larutan ditambahkan 1 mL NaOH 0,5 M, berapakah pH larutan sekarang?
c. Jika yang ditambahkan adalah 1 mL H2SO4 0,25 M, berapakah pH larutan jadinya?
JAWAB
1. Larutan buffer (penyangga) adalah larutan yang dapat menjaga (memepertahankan) nilai ph, meskipun ditambahkan sedikit asam,sedikit basa, atau sedikit air (pengenceran)
2. Larutan yang dapat menghasilkan larutan buffer adalah larutan yang terdiri dari
a. Campuran asam lemah dengan garamnya
Contoh: CH3COOH + NaOH ® CH3COONa + H2O
ATAU
Larutan penyangga asam : merupakan larutan penyangga yang terdiri dari komponen pasangan asam lemah dangan basa konjugasinya
b. Campuran basa lemah dengan garamnya
Contoh: NH4OH + HCl®NH4Cl + H2O
ATAU
Larutan penyangga basa : merupakan larutan penyangga yang terdiri dari komponen pasangan basa lemah dengan asam konjugasinya
3. dari larutan berikut yang mana yang menghasilkan larutan buffer:
a. campuran 100mL HCN 0,1 M + 10 mL NaCN 0,1 M
karena campuran terdiri atas asam lemah HCN di sertai basa konjugasi atau garam konjugasi yaitu NaCN maka campuran merupakan penyangga asam
b. Campuran 100 mL CH3COOH 0,1 M + 100 mL KOH 0,1 M
CH3COOH + KOH ® CH3COOK + H2O
Mol CH3COOH = 10 mL x 0,1M
= 10 mmol
Mol KOH = 100 mL x 0,1M
= 10 mmol
karena jumlah mol dan koefisien reaksi sama, maka kedua spesi akan habis bereaksi sehingga akan membentuk hidrolisis garam. sehingga campuran B bukan penyangga
c. Campuran 20 mL CH3COOH 0,1 M + 10 mL NaOH 0,5 M
CH3COOH + NaOH ® CH3COONa + H2O
Mol CH3COOH = 20 mL x 0,1 M
= 2 mmol
Mol NaOH = 10 mL x 0,5 M
= 5 mmol
Campuran C bukan larutan penyangga melainkan campuran yang bersifat basa
d. Campuran 10 mL HCl 0,5 M + 20 mL NaCl 0,1 M
Mol HCl = 10 mL x 0,5 M
= 5 mmol
Mol NaCl = 20 mL x 0,1 M
= 2 mmol
HCl + NaCl ⇋ NaH- + Cl 2
campuran D bukan larutan penyangga melainkan reaksi hidrolisis
e. Campuran 100 mL CH3COOH 0,1 M + 100 mL NH4Cl 0,1 M
Mol CH3COOH = 10 mL x 0,1 M
= 1 mmol
Mol NH4Cl = 100 mL x 0,1 M
=10 mmol
Campuran E bukan merupakan larutan penyangga karena bukan pasangan asam dan basa konjugasi
f. Campuran 10 mL NH4OH 0,1 M + 30 mL (NH4)2SO4 0,1 M
(NH4)2SO4 + NH4OH ⇋ (NH4)2OH + NH4SO4
Mol NH4OH = 10 mL x 0,1 M
= 1 mmol
Mol (NH4)2SO4 = 30 ml x 0,1 M
=3 mmol
Campuran F merupakan penyangga basa karena terdiri dari komponen basa
lemah dan asam konjugasi atau garam konjugasi
g. Campuran 10 mL NH4OH 0,5 M + 20 mL HNO3 0,1 M
NH4OH + HNO3 ® NH4NO3 + H2O
Mol NH4OH = 0,5 M x 10 mL
= 5 mmol
Mol HNO3 = 0,1 M x 20 mL
= 2 mmol
campuran G merupakan penyangga basa karena mol basa lemah lebih banyak pada perbandingan koefisien yang sama
h. Campuran 100 mL NH4OH 0,1 M + 50 mL H2SO4 0,1 M
2NH4OH + H2SO4 ® (NH4)2SO4 + 2H2O
Mol NH4OH = 100 mL x 0,1M
= 10 mmol
Mol H2SO4 = 50 mL x 0,1 M
= 5 mmol
Campuran H merupakan penyangga basa karena mol basa lemah lebih banyak pada perbandingan koefisien yang sama
i. Campuran 100 mL NH4OH 0,1 M + 50 mL H2SO4 0,1 M
NaOH + HCl ® NaCl + H2O
Mol NaOH = 100 mL x 0,5 M
= 50 mmol
Mol HCL = 100 mL x 0,1 M
= 10 mmol
Campuran I bukan penyangga karena reaksi anatara asam kuat dan basa kuat
j. Campuran 100 mL NH4OH 0,1 M + 50 mL HCl 0,05 M
Mol NH4OH = 100 mL x 0,1 M
=10 mmol
Mol HCl = 5o mL x 0,05 M
= 2,5 mmol
Campuran merupakan penyangga basa karena mol basa lemah lebih banyak pada perbandingan koefisien reaksi yang sama
4. Diketahui: V CH3COOH = 50 mL
m CH3COOH = 0,1 M
V Ca(OH)2 = 20 mL
m Ca(OH)2 = 0,1 M
Ka CH3COOH = 1 x 10 -5
Ditanya : pH larutan sebelum dan sesudah dicampur...?
Jawab:
a. Sebelum dicampur
[H+] = √Ka x Ma
= √1x10-5 x 0,1 M
= √1 x 10 -6
= 1 x 10 -3
pH = -log [H+]
= -log 1x10-3
= 3 -log 1
= 3
Ca(OH)2 = basa kuat
Reaksi ionisasi :
Ca(OH)2(aq) ® Ca2 (aq) + 2OH-(aq)
[OH-] = valensi basa x m
= 2 x 0,1
= 0,2
POH = -log [OH-]
= - log 0,2
= 1-log 2
pH = 14 - POH
= 14 - (1 -log 2)
= 13 log 2
5. Diketahui : V NH4Cl = x mL
m NH4Cl = 0,1 M
V NH3 = y mL
m NH3 = 0,1 M
Kb NH3 = 1x10-5
pH = 8
Ditanya : perbandingan volume NH4Cl dan NH3
Jawab :
Mol NH4Cl = m.V
= 0,1 M . x mL
= 0,1 x mmol
Mol NH3 = m.V
= 0,1 M . y mL
= 0,1 y mmol
NH4 + HCl ® NH3Cl
Asam konjugasi basa
Mol NH3 = 0,1 x - 0,1 y mmol
Mol NH4 = 0,1 x
pH = 8
POH = 14 - pH
= 14 - 8
= 6
POH = 6
[OH] = 10-6
6. Diketahui : Mr Ca (CH3COO)2 = 158
V CH3COOH =100 mL
m CH3COOH = 0,1 M
Ka CH3COOH = 10-5
pH = 5 -log2
Ditanya : Berapa gram Ca(CH3COO)2harus ditambahkan ke dalam 100 mL larutan
CH3COOH 0,1 M sehingga pH nya menjadi dua kali semula?
jawab :
7. Diketahui : m HCOOH = 690 mg
m NaHCOO = 566 mg
V air = 100 mL
Ka HCOOH = 2 x 10-4
Ditanya :
a. Tentukanlah pH larutan tersebut.
b. Jika ke dalam larutan ditambahkan 1 mL NaOH 0,5 M, berapakah pH larutan sekarang?
c. Jika yang ditambahkan adalah 1 mL H2SO4 0,25 M, berapakah pH larutan jadinya
Jawab :
a.
pH = -log [H+]
= -log (3,25 x 10-4)
= 4-log 3,25
= 3,49
b. NaOH 1 mL 0,5 M yang ditambahkan akan bereaksi
Mol NaOH = 1 mL x 0,5 M
= 0,5 mmol
Mol OH- = 1 mL x 0,5 M
= 0,5 mmol
= 5 x 10-4 mol
= 2,96 . 10-4
pH = -log (2,96 . 10-4)
= 4 -log 2,96
= 3,53
c. Ditambahkan 1 mL H2SO4 0,25 M berapa pH nya?
Mol H2SO4 = 1 mL . 0,25 M
= 0,25 mmol
Mol H+ = 2 . 0,25 M
= 0,5 mmol
= 5 . 10-4 mol
TITRASI ASAM BASA
Modul halaman 50. nomor 1 & 2
1. Diketahui : V HNO3 = 50 mL
m NaOH = 0,2 M
percobaan ke- | larutan HNO3 | Larutan NaOH |
1 | 10 mL | 18 mL |
2 | 10 mL | 12 mL |
Ditanya : konsentrasi larutan HNO3...?
Jawab:
Misal A=HNO3 B=NaOH
VA . MA . nA = VB . MB . nB
10 . MA. 1 = 15 . 0,2 . 1
10 MA = 3
Konsentrasi larutan HNO3 yaitu 0,3 M
2. Diketahui : V CH3COOH = 25 mL
m NaOH = 0,01 M
Data hasil titrasi:
a. Volume NaOH = 51 mL
b. Volume NaOH = 49 mL
c. Volume NaOH = 50 mL
Ditanya : konsentrasi asam cuka (CO3COOH)....?
Jawab:
V1 . M1 . n1 = V2 . M2 . n2
50 . 0,01 . 1 = 25 . M2 . 1
0,5 = 25M2
M2 = 0,02 M
Konsentrasi asam cuka (CH3COOH) yaitu 0,02 M
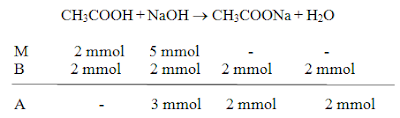












semangat belajarnya ya nak
BalasHapussiap buk
BalasHapus